O Epichaperoma na doença de Alzheimer: o efeito dos estressores nas redes de proteínas (por StressMarq Biosciences)
Estresse e Neurodegeneração
O corpo humano enfrenta uma variedade de estressores ao longo da vida, incluindo fatores genéticos e ambientais. O estresse é a resposta de um organismo a esses estressores. Enquanto o estresse leve pode ter efeitos positivos no sistema nervoso humano, o estresse crônico pode levar a déficits neuronais e neurodegeneração (1,2). O hipocampo, que tem papel importante no aprendizado e na memória, é a área cerebral mais vulnerável que sofre neurodegeneração sob estresse crônico (3). Na Doença de Alzheimer (DA), um distúrbio neurodegenerativo crônico, os estressores causam desequilíbrios na conectividade de redes neurais, proteínas neuronais e vias proteicas importantes para a formação e
função de sinapses (4).
O que é uma Epichaperoma?
As chaperonas moleculares, como as proteínas de choque térmico (HSPs), são ativadas sob condições de estresse e desempenham papel crucial no dobramento e desdobramento de proteínas, bem como na degradação
e desagregação de proteínas. As acompanhantes, co-acompanhantes e enzimas dobráveis compõem o acompanhante que, sob estresse celular, forma redes proteicas estáveis conhecidas como Epichaperoma. Estudos anteriores mostraram que a rede Epichaperoma também está envolvida no crescimento e sobrevivência do tumor (6).
Proteínas de choque térmico e distorção da Tau
HSP90 e HSP70 regulam a homeostase da tau. Especificamente, o complexo HSP90/co-chaperona regula a dobragem da tau e o complexo co-chaperona HSP70/CHIP (terminal carboxílico da proteína de interação HSP70) medeia a degradação da tau (5). Em tauopatias como a de Alzheimer, a homeostase da tau é interrompida, levando à sua hiperfosforilação e ao acúmulo de agregados intracelulares.
Como a Epichaperoma está envolvido na doença de Alzheimer?
Um estudo recente publicado na Nature Communications mostra como a mudança do chaperoma para a epichaperoma perturba as redes de proteínas, levando à disfunção baseada em conectividade protéica
(PCBD) e ao declínio cognitivo. Maria Karmen Inda, Suhasini Joshi, Tai Wang e Alexander Bolaender, primeiros autores, no Memorial Sloan Kettering Cancer Center, propuseram que a DA é um distúrbio baseado em conectividade protéica.
Os pesquisadores compararam camundongos transgênicos PSu tau, que expressam tau mutante P301S humano, a camundongos do tipo selvagem, e descobriram que os cérebros do camundongo PS19 continham mais epichaperomas do que seus colegas do tipo selvagem. Curiosamente, os epichaperomas formadas antes do desenvolvimento da patologia da tau, o que sugere que eles podem permitir a formação de emaranhados da tau.
Resultados semelhantes foram observados quando os pesquisadores compararam tecidos cerebrais de pacientes com DA ao normal da mesma idade. Eles descobriram um número epichaperomas significativamente maior nos tecidos cerebrais da DA.
Efeitos da Formação da Epichaperoma
Pesquisadores usaram grânulos para capturar o epichaperoma e sua interatômica e analisar redes de interação proteína-proteína (PPI). Eles descobriram que a formação de epichaperoma induzia a disfunção sináptica. Eles confirmaram isso com a superexpressão da tau nas células N2a (neuroblastoma de camundongo), que induziram desequilíbrios nas redes de proteínas sinápticas. Várias vias tornaram-se desreguladas devido à potencialização a longo prazo (LTP) com defeito.
Alvos PU-AD na Epichaperoma
O grupo de pesquisa do Dr. Chiosis no centro Memorial Sloan Kettering Cancer desenvolveu o inibidor sintético de andaimes de purina PU-H71, que tem como alvo HSP90 no epichaperoma das células cancerígenas (6).
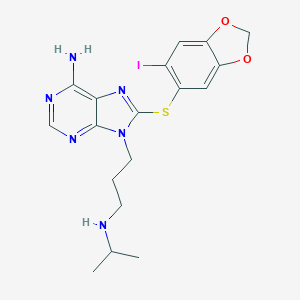
(https://pubchem.ncbi.nlm.nih.gov/compound/pu-h71)
Neste estudo, o mesmo grupo desenvolveu uma sonda química chamada PU-AD que inibe o epichaperoma, retornando a conectividade de rede e os desequilíbrios funcionais aos níveis normais. O PU-AD, como o PU-H71, inibe a HSP90, aumentando a degradação da tau mutada ou hiperfosforilada.
Os pesquisadores trataram camundongos PS19 com PU-AD e usaram químicos chaperômicos para detectar e analisar disfunções da rede de proteínas sinápticas. A administração da droga levou a uma redução nas disfunções da conectividade protéica e os camundongos demonstraram melhora da memória e maior sobrevida sem efeitos colaterais. Os resultados indicaram a eficácia e segurança do PU-AD, que agora está sendo testado em pacientes humanos.
Os anticorpos HSP90, HSP70/HSC70 e HSP110 da StressMarq foram usados para Western Blot na análise epichaperoma de amostras de cérebro de camundongo e humano e células N2a que superexpressam a tau humana. O trabalho de pesquisa original foi publicado na Nature Communications em janeiro de 2020.
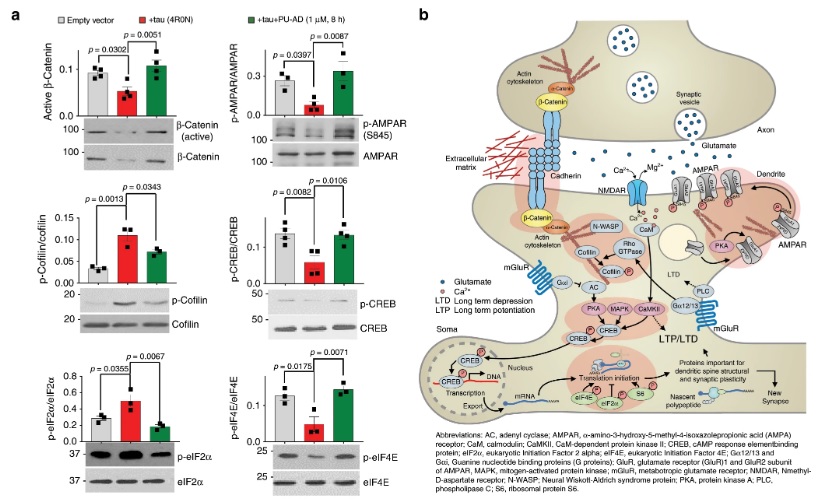
a) Gráfico, média ± SEM, ANOVA unidirecional, post hoc de Dunnett, n = 3-4 experimentos independentes.
b) Resumo esquemático das vias sinápticas alteradas nas células AD e N2a-tau através da formação da rede epichaperoma. Os efetores funcionais das vias proteicas escolhidas para validação em (a) são destacados com um contorno vermelho. Ver também Fig. 5.
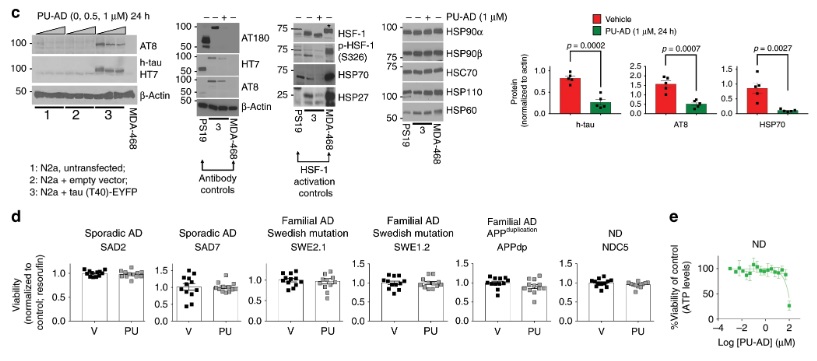
c) As análises de Western blot não mostram ativação do HSF-1 sob condições em que os níveis de tau e tau fosforilada diminuem com o tratamento com PU-AD. Os lisados de células cancerígenas MDA-MB-468 foram utilizados como controle para a presença de HSF-1 ativo (indicado com um asterisco). Níveis das proteínas de choque térmico induzíveis HSP70 e HSP27, marcadores substitutos da ativação do HSF-1, também foram investigados. O nível de expressão de membros acompanhantes individuais (HSP90s, HSC70, HSC60, HSP110) também é mostrado. O gráfico representa, ± SEM, teste t bicaudal não pareado, n = 3.
d, e) Viabilidade de neurônios derivados de iPSC cultivados por 24 h com Veículo (V) ou PU (0,5 µM PU-AD) (d) ou para 72 h com concentrações de PU-AD de 0 a 100 µM (e). O gráfico representa, ± EPM, n = 12 para (d) en = 4 para (e). P <0,05, ** P <0,01, *** P <0,001.
Os dados de origem são fornecidos como um arquivo de dados de origem.
Fonte: https: //www.nature.com/articles/s41467-019-14082-5/figures/6
REFERÊNCIAS:
- McEwen, B. S. The brain on stress: toward an integrative approach to brain, body, and behavior. Perspect. Psychol. Sci. 8, 673–675 (2013).
- Arnsten, A. F. Stress weakens prefrontal networks: molecular insults to higher cognition. Nat. Neurosci. 18, 1376–1385 (2015).
- Bartsch, T. & Wulff, P. The hippocampus in aging and disease: from plasticity to vulnerability. Neuroscience 309, 1 –16 (2015).
- Querfurth, H. W. & LaFerla, F. M. Alzheimer’s disease. N. Engl. J. Med. 362, 329–344 (2010).
- Thompson, A. D. et al. Analysis of the tau-associated proteome reveals that exchange of Hsp70 for Hsp90 is involved in tau degradation. ACS Chem. Biol. 7, 1677–1686 (2012).
- Pillarsetty, N. et al. Paradigms for precision medicine in epichaperome cancer therapy. Cancer Cell 36, 559–573 (2019).
ESCRITO POR Christina Korgiopoulou